5.- Entropía
La irreversibilidad de los procesos puede estudiarse mediante el concepto de entropía. Dicha magnitud es una variable de estado que mide el grado de desorden del sistema. Cuando pensamos en un proceso irreversible (expansión de un gas hasta ocupar todo un recipiente, traspaso de calor de un cuerpo más caliente a uno más frío, etc) vemos que el sentido posible siempre coincide con aquel en que aumenta el desorden del sistema. En consecuencia, el segundo principio de la Termodinámica puede formularse en función de la entropía: en todo proceso físico la entropía aumenta o permanece constante (la igualdad sucede en los procesos reversibles).
Podemos calcular la variación de entropía entre dos estados con la expresión:
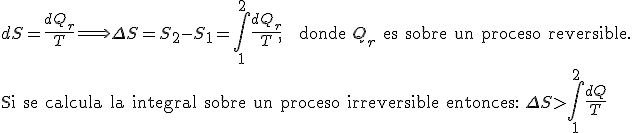
ALGUNAS CONSIDERACIONES GENERALES SOBRE LA ENTROPÍA:
- En transformación adiabática reversible su variación es cero, puesto que dQ=0. En irreversible dQ>0.
- En transformación isotérmica:

- En transformación isócora como
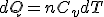 :
:

- En transformación isobara del mismo modo:
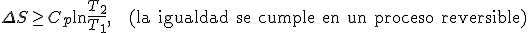
- En un ciclo
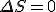 , por ser la entropía una función de estado.
, por ser la entropía una función de estado. - En un ciclo de Carnot sólo hay variación de entropía en las dos isotermas, pero la suma ha de ser cero por ser un ciclo. Así, se cumple:
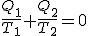 , expresión que sirve para definir el cociente de temperaturas absolutas.
, expresión que sirve para definir el cociente de temperaturas absolutas. - La variación de entropía del universo en un proceso reversible es cero.
- La variación de entropía del universo en un proceso irreversible es positiva.
- En un proceso irreversible en el que la variación de entropía es
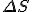 , parte de la energía se convierte en inutilizable para realizar trabajo. La cantidad de energía que pasa a ser inutilizable es igual a
, parte de la energía se convierte en inutilizable para realizar trabajo. La cantidad de energía que pasa a ser inutilizable es igual a 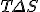 , donde T es la temperatura del foco utilizado a Temperatura más baja.
, donde T es la temperatura del foco utilizado a Temperatura más baja. - Utilizando el primer principio de la termodinámica y la definición de entropía se obtiene la expresión:
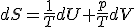
- Para un gas ideal:
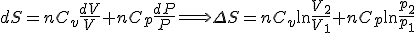

Física I by Esther Jódar Ferrández, José Luis Sánchez Méndez is licensed under a Creative Commons Reconocimiento-NoComercial-CompartirIgual 3.0 Unported License.
Based on a work at ocw.bib.upct.es.