1.- Variables termodinámicas y tipos de procesos
Llamamos "estado" a cada una de las situaciones en que puede encontrarse un sistema termodinámico, siendo descritos cada uno de estos estados por las "variables de estado" termodinámicas. El estudio de un sistema termodinámico se puede abordar desde dos puntos de vista:
- FÍSICA ESTADÍSTICA: dado que el número de partículas que componen un sistema termodinámico (macroscópico) es muy grande, se pueden aplicar leyes estadísticas al movimiento microscópico de las partículas y relacionarlo con las propiedades macroscópicas del mismo.
- TERMODINÁMICA CLÁSICA: estudia el comportamiento de las propiedades observables del sistema únicamente desde el punto de vista macroscópico. Su objetivo es encontrar un conjunto adecuado de parámetros para estudiar las leyes de los distintos sistemas. Estos parámetros son las "variables termodinámicas", que pueden ser EXTENSIVAS (cuando su valor es proporcional a la cantidad de materia del sistema, ej: volumen, masa,...) o INTENSIVAS (cuando su valor es independiente de la cantidad de materia, ej: p,
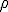 ,... incluidas aquí las magnitudes específicas, que son las extensivas por unidad de volumen, como
,... incluidas aquí las magnitudes específicas, que son las extensivas por unidad de volumen, como 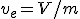 )
)
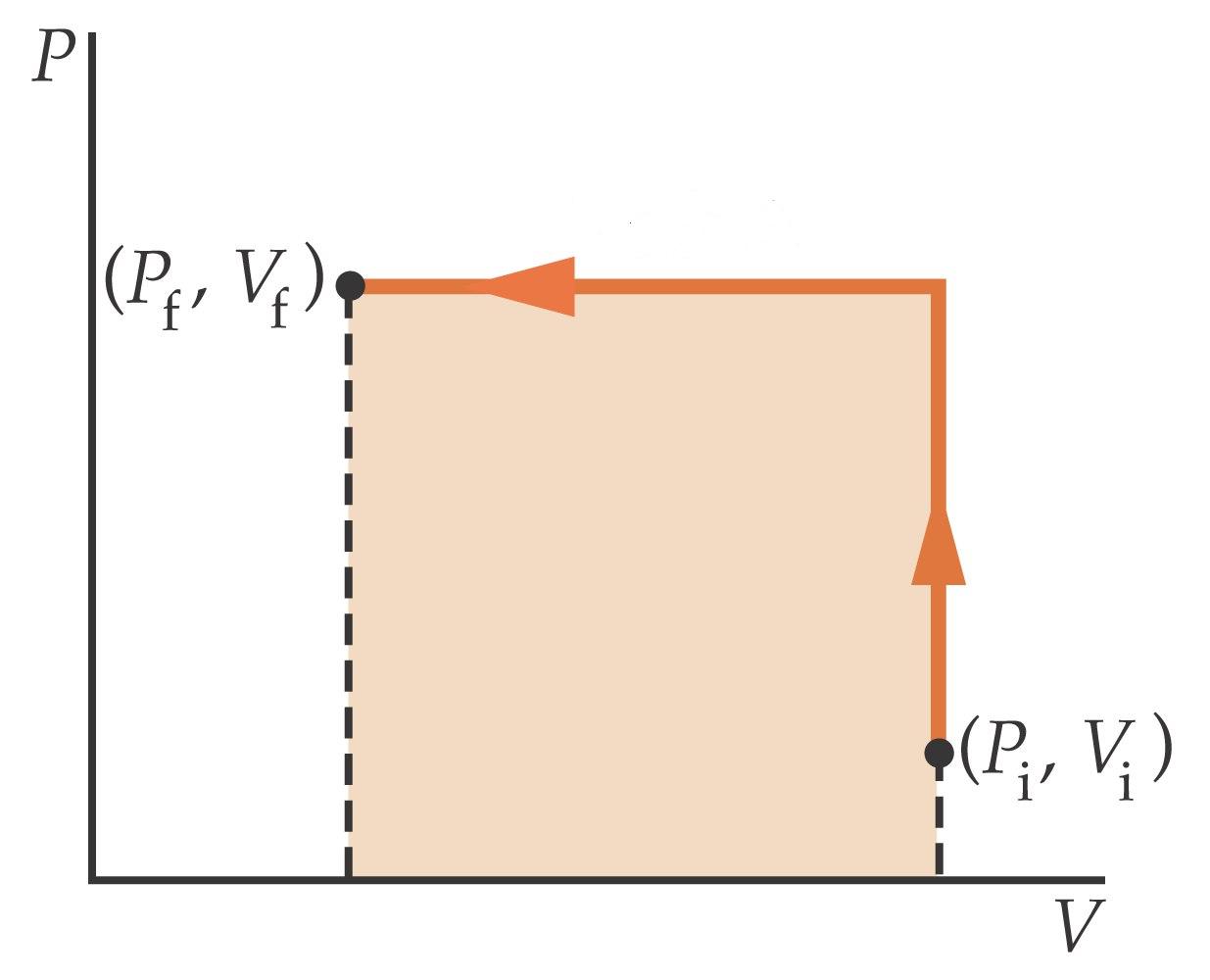
- PROCESO ISÓCORO (V=cte.): representado por una línea vertical en el diagrama P-V.
-
PROCESO ISÓBARO (p=cte): representado por una línea horizontal en el diagrama P-V (ver figura superior).
-
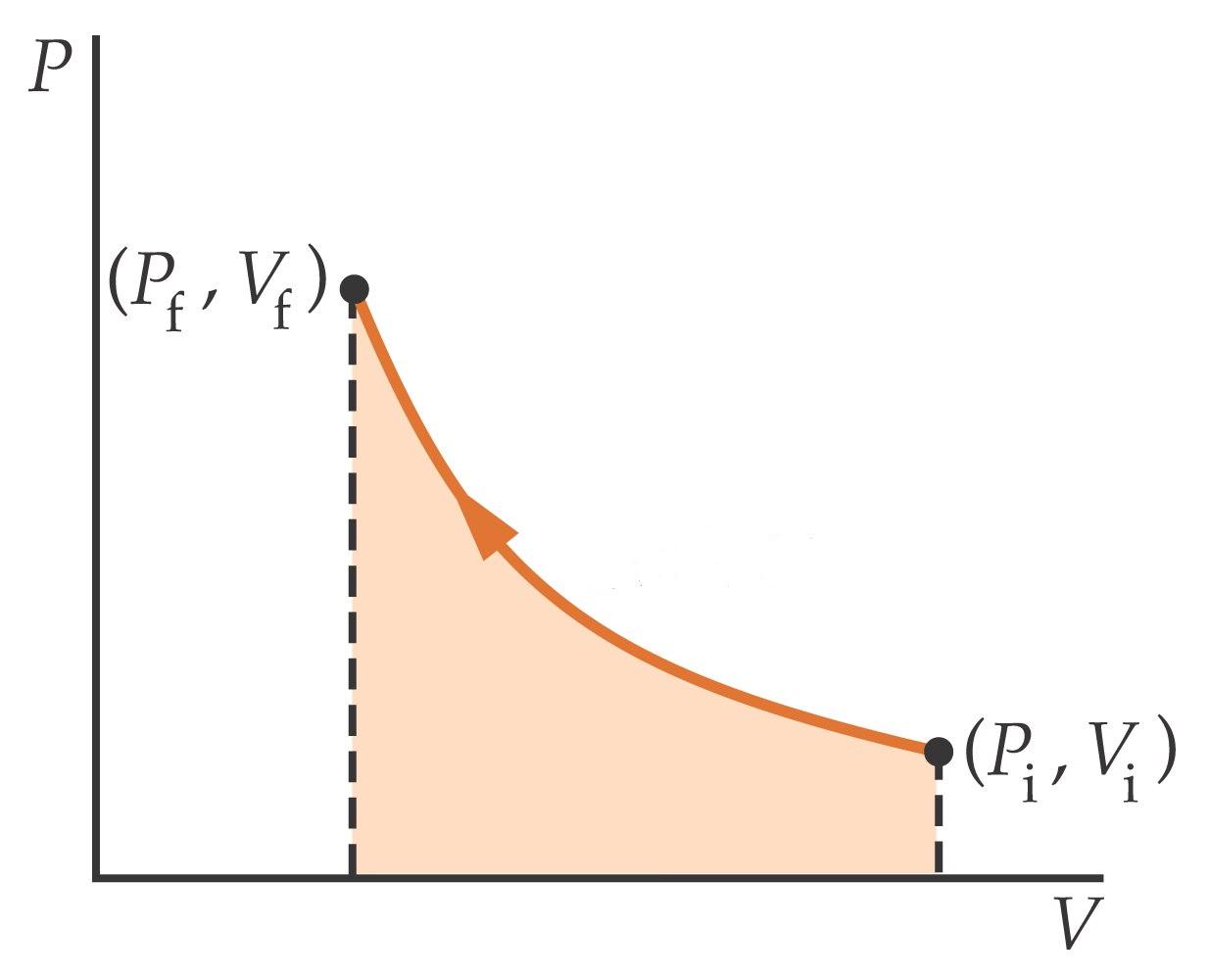
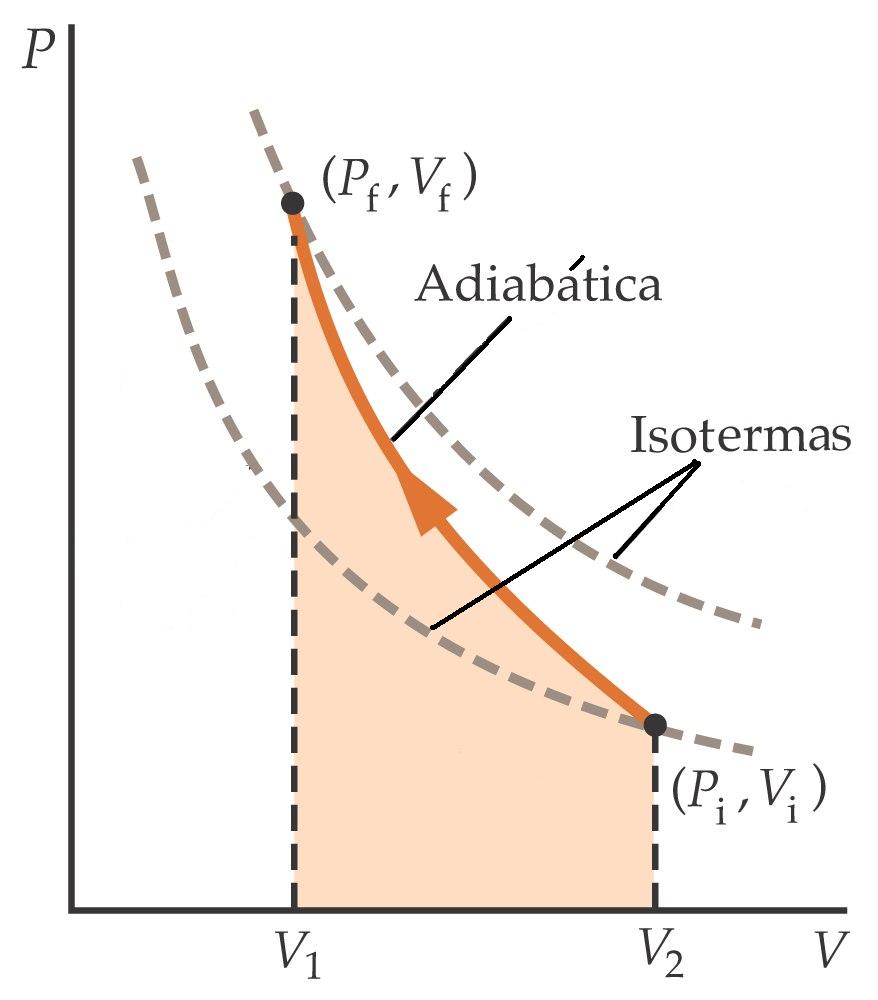
PROCESO ISOTÉRMICO (T=cte): representado por una curva en el diagrama P-V ( En la forma representada en la figura inferior).
-
PROCESO ADIABÁTICO (no hay intercambio de calor, Q=0): también se representan por una curva en el diagrama P-V, pero su pendiente es mayor que la de las isotermas.

Física I by Esther Jódar Ferrández, José Luis Sánchez Méndez is licensed under a Creative Commons Reconocimiento-NoComercial-CompartirIgual 3.0 Unported License.
Based on a work at ocw.bib.upct.es.